Flagellin alapú fúziós fehérjén alapuló újfajta oltóanyag molekula fejlesztése 2020-2.1.1-ED-2020-00013; 2020-2022
Témavezető: Dr. Vonderviszt Ferenc
Összefoglalás
A koronavírus járvány elleni küzdelemhez kapcsolódóan egy újfajta fehérje alapú oltóanyag molekula fejlesztésén dolgozunk, ami egyszerre hordoz virális antigént és a veleszületett immunválaszt stimuláló szegmenseket is. A baktériumok mozgásszervét, a flagelláris filamentumokat felépítő flagellin fehérjéről ismert, hogy a konzerválódott terminális régiói a TLR5 receptorral való intenzív kölcsönhatás révén stimulálják a veleszületett immunrendszert. Ötletünk lényege, hogy a koronavírus tüskefehérje célsejt felismeréséért felelős receptorkötő (CTD) doménjét, beültetjük a flagellin változékony középső részébe, és így egy olyan fúziós fehérjét állítunk elő, ami egyszerre stimulálja a veleszületett és a szerzett immunrendszert is, és ezáltal képes hatékony immunválaszt kiváltani. Először csirke, majd a későbbiekben sertés koronavírus modelleken demonstráljuk az elképzelés működőképességét. További ígéretes lehetőség, hogy a flagellin polimerizációs képességénél fogva a flagellin-CTD fúziós fehérjékből kontrollált hosszúságú nanorudak építhetők vagy akár nanoszálakat képezhetnek a gazdasejtek felszínén, sok száz példányban megjelenítve a beépített virális antigént. Ezeket a vírus-szerű részecskéket és vírusrészeket prezentáló baktériumokat ugyancsak tesztelni kívánjuk potenciális oltóanyagként. Azért is fontosnak gondoljuk ezt a koncepciót kipróbálni, mert egyéb vírusok elleni oltóanyagok fejlesztésénél is előnyös lehet.
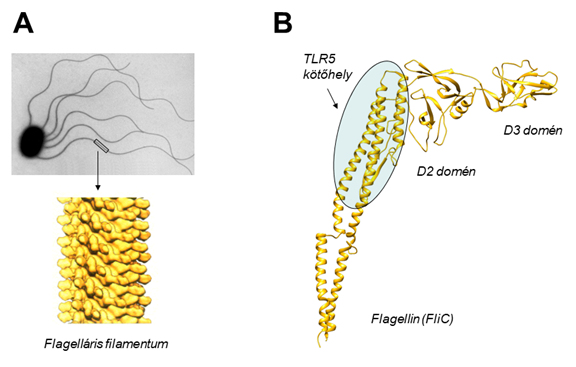
1. ábra (A) Egy szalmonella baktérium elektronmikroszkópos képe. A sejt felszínén található flagelláris filamentumok több ezer flagellin alegységből épülnek fel. (B) A flagellin fehérje polipeptidvázának szerkezeti modellje. A molekula variábilis D2-D3 doménjeinek helyére a polimerizációs képesség megzavarása nélkül idegen fehérjék beépíthetők.
Bevezetés
A Pannon Egyetem, a Ceva-Phylaxia Zrt. és a TargetEx Kft. együttműködésében megvalósuló projekt keretében egy olyan flagellin (FliC) alapú újfajta oltóanyag molekula fejlesztését tűztük ki célul, ami egyszerre hordoz virális antigént (tüskefehérje receptorkötő CTD domén) és a veleszületett immunválaszt stimuláló szegmenseket (flagellin TLR kötőhelyek) is. Az első munkaszakaszban csirke koronavírus (IBV) modellen kívánjuk demonstrálni az elképzelés működőképességét.
Miért előnyös a flagellin hordozó molekulaként való használata? A baktériumok felszínén található flagelláris filamentumok sok ezer flagellin alegységből épülnek fel (1. ábra). Ha a baktériumok a szervezetünkbe kerülnek, akkor immunrendszerünk először az idegen flagellin fehérjével szembesül nagy mennyiségben. Ez magyarázza, hogy a flagellin konzerválódott terminális régiói a TLR5 receptorral való intenzív kölcsönhatás révén erősen stimulálják a veleszületett immunrendszert. A flagellin változékony középső részébe, a filamentumok felületén található D2-D3 domének helyére úgy próbáljuk beépíteni a virális szegmenseket, hogy a flagellin polimerizációs képessége megmaradjon. Így ezek a fúziós fehérjék ideális esetben filamentumok formájában megjelennek a baktérium gazdasejtek felszínén, amelyek sok ezer példányban prezentálják a virális antigént, s ahonnan a baktériumok feltárása nélkül egyszerűen izolálhatók. Az előállított fúziós fehérjék önszerveződőképességét kihasználva belőlük akár több száz fehérje alegységből álló vírusszerű részecskéket építhetünk, de elölt formában a filamentumokat hordozó teljes baktériumsejtek is alkalmazhatók lehetnek oltóanyagként.
Fúziós fehérjék tervezése és előállítása
Számítógépes molekulamodellezés segítségével megterveztük az előállítani kívánt fúziós fehérjéket. Befogadó konstrukcióként a D3 doméntől vagy a D2-D3 doménpártól megfosztott flagellin molekulákat (FliC_delD3; FliC_delD2D3) alkalmaztuk, amelyek tartalmazzák a D1 doménben található, a veleszületett immunrendszer stimulálására képes toll-like-receptor (TLR5) kötőhelyet. Virális antigénként az IBV_CTD domént (az IBV tüskefehérje 268-415 szegmense) vagy ennek az SD1 aldoménnel kibővített változatát (IBV_CTD_SD1: az IBV tüskefehérje 249-492 szegmense) használtuk. Az IBV_CTD_SD1 szegmens a tüskefehérje nagyobb darabját és több epitópját tartalmazza, ami az IBV_CTD-hez képest erősebb immunválaszt eredményezhet. A FliC_delD2D3 alapú konstrukciók előnyös tulajdonsága lehet a flagellin elleni csökkent mértékű adaptív immunválaszt, ami így dominánsan a beépített vírus antigén ellen irányulhat. Az antigén flagellinbe illesztésénél kritikus a megfelelő linker szegmensek alkalmazása, amelyek lehetővé teszik, hogy mindkét partner képes legyen felvenni funkcionális térbeli szerkezetét.
Az alábbi 4 féle fúziós fehérjét kódoló génkonstrukciókat készítettük el:
- FliC_delD2D3-IBV_CTD
- FliC_delD2D3-IBV_CTD_SD1
- FliC_delD3-IBV_CTD
- FliC_delD3-IBV_CTD_SD1
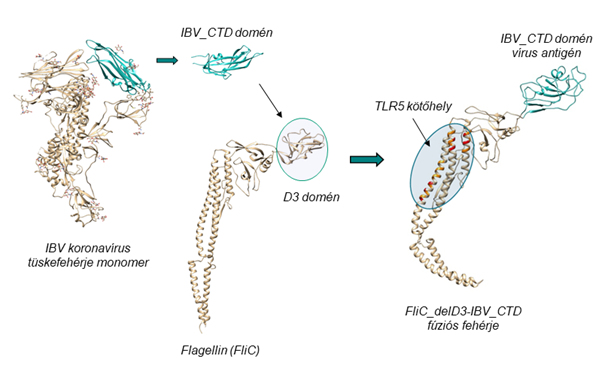
2. ábra Vírusantigént hordozó flagellin variáns előállítása. Ebben a példában a madár koronavírus (IBV) tüskefehérje receptorkötő doménje (IBV_CTD; világoskék) került beépítésre megfelelő linkerek alkalmazásával a flagellin D3 doménjének helyére.
A fúziós fehérjéket kódoló plazmidokat többféle befogadó organizmusban (E. coli, S. typhimurium, rovarsejtek) expresszálva azt tapasztaltuk, hogy a termelődött fúziós konstrukciók minden esetben a gazdasejtek belsejében aggregálódtak és zárványtesteket képeztek, filamentumok nem alakultak ki a sejtek felszínén, ezért eljárást dolgoztunk ki a fúziós fehérjék zárványtestekből való kinyerése és legalább részleges feltekerése érdekében. Az IBV_CTD_SD1 szegmenst tartalmazó konstrukciók valószínűleg instabilitási problémák miatt gyengén termelődtek, ezért az oltóanyag minták előállítását már csak a FliC_delD3-IBV_CTD és a FliC_delD2D3-IBV_CTD variánsokkal folytattuk.
Oltási próbakísérletek
Az állatkísérletekhez nagyobb léptékű bakteriális fehérjeexpressziót alkalmazva az elvégzett fehérjexpressziós és refolding kísérletek alapján többféle, kontrollált méretű asszociátumokat tartalmazó és kellő stabilitással rendelkező potenciális vakcina mintát hoztunk létre:
- A bakteriális termeltetés során a FliC_delD2D3-IBV_CTD, illetve a FliC_delD3-IBV_CTD fúziós fehérjékből képződő, részben feltekeredett fehérjéket tartalmazó inklúziós test preparátumokat állítottunk elő, amelyek 4°C-on jelentős aggregálódás nélkül eltarthatók, dinamikus fényszórásmérés alapján méretük az alkalmas 800-1000 nm tartományban található.
- A részlegesen denaturáló körülmények között Ni-affinitás oszlopon tisztított mintákat is készítettünk, amelyek a FliC_delD2D3-IBV_CTD esetén ~70nm nagyságú, míg a FliC_delD3-IBV_CTD esetében ~50nm átmérőjű asszociátumokat tartalmaztak. Mindkét esetben a minták hűtőben vagy fagyasztóba tárolva is stabilak maradtak, és méreteloszlásuk alapján alkalmasak oltási kísérletek végzésére.
Az antigéneket víz az olajban (w/o) típusú adjuvánsal egészítettük ki az immunválaszt kiváltó képesség növelése céljából és csirkékkel oltási kísérleteket végeztünk. A vizsgálat során csoportonként 10 darab 3 hetes csirkét vakcináztunk 3 hetes időközzel. Az immunválasz kimutatására a vakcinázást megelőzően, valamint az első vakcinázást követő 14., 21., 28. és 35. napokon vért vettünk. Az antigének IBV CTD tartalmának meghatározásához specifikus immunológiai módszert fejlesztünk. Folyamatban van az oltóanyag minták immunválasz kiváltó képességének értékelése.
Ígéretes, hogy az oltási kísérletek alapján látunk immunválaszt, azonban a fúziós fehérjék zárványtestből való tisztítása technológiailag bonyolult és költséges folyamat. Mindenképpen kívánatos volna olyan körülmények kialakítása, hogy a virális antigént hordozó flagellin molekulák filamentumokat alkossanak a gazdasejtek felszínén. Ennek érdekében különféle feltekeredést segítő fehérjék (chaperonok) együttes expresszálásával végzünk további kísérleteket.
Flagellin alapú általános oltóanyag koncepció
A flagellin alapú oltóanyag koncepció sokféle vírus esetén alkalmazható lehet. Próbakísérletet végeztünk, hogy más vírus esetén sikerül-e könnyebben megvalósítani a virális antigént nagy számban megjelenítő filamentumok előállítására vonatkozó elképzeléseinket.
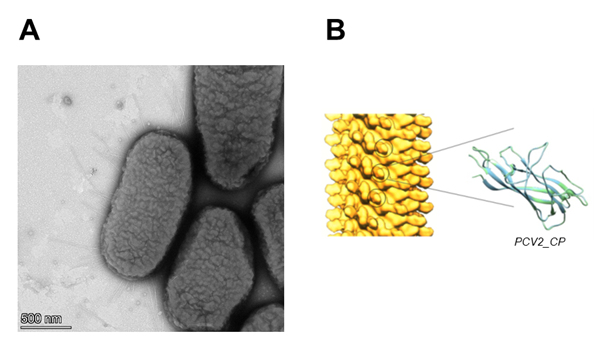
3. ábra (A) PCV2_CP vírusburok fehérjét tartalmazó flagellin alegységekből álló filamentumokat növesztő szalmonella sejtek. (B) Egy rövid filamentum darab térkitöltéses modellje. A beépített vírus antigén sok száz példányban megjelenik a filamentumok felszínén.
A sertés cirkovírus-2 (PCV2) minden évben világszerte több 10 millió kismalac halálát okozza, hatalmas gazdasági veszteséget eredményezve. Előkísérleteink szerint a PCV2_CP vírusburok fehérjét a flagellin D3 doménjének helyére beépítve létrehozott fúziós fehérje képesnek bizonyult rövid filamentumokat jelentős számban kialakítani a flagellin deficiens SJW2536 szalmonella gazdasejtek felszínén (3. ábra). Figyelembe véve, hogy egy 100 nm hosszúságú filamentum darab felületén közel 200 vírus antigén található, a FliC_delD3-PCV2_CP filamentumokat hordozó elölt sejtek vakcinaként kiválóan alkalmazhatóak lehetnek.
Biomimetic formation and organization of magnetite nanoparticles, ERA-Chemistry/ OTKA NN117640 projekt;
társtémavezető: Dr. Vonderviszt Ferenc
Az élőlények által kiválasztott, a szervezet részét alkotó és valamilyen biológiai funkció ellátására specializált bioásványok sokszor különleges tulajdonságúak: szűk méret- és alakeloszlás, kémiai tisztaság, olykor szokatlan, nem-egyensúlyi morfológia jellemző rájuk. Megfelelően módosított flagellinekből képzett flagelláris filamentumokat biomineralizációs folyamatokban templátként alkalmazva kívánunk mágneses nanoszálakat előállítani. 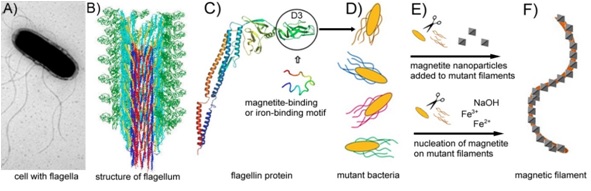
GINOP-2.3.2-15 – Stratégiai K+F műhelyek kiválósága; Bionanotechnológiai kutatások betegségek hatékony kimutatása, újfajta hatóanyagok kifejlesztése és bioinspirált intelligens nanoanyagok előállítása érdekében; Funkcionalizált flagellinek alprojekt
Projektvezető: Dr. Guttman András
Alprojektvezető: Dr. Vonderviszt Ferenc
A három alprogramot magában foglaló projekt fókuszpontjai (1) a betegségek hatékony kimutatását szolgáló mikro- és nanodiagnosztikai eljárások fejlesztése, (2) a gyógyászatban és környezetvédelmi analitikában alkalmazható funkcionális nanorészecskék létrehozása, valamint (3) önszerveződő intelligens nanoanyagok előállítása.
„M-ERA.NET-WaterSafe: Sustainable autonomous system for nitrites/nitrates and heavy metals monitoring of natural water resources”/OTKA NN117849 projekt, 2016-2018.
témavezető: Dr. Vonderviszt Ferenc
Az élőlények által kiválasztott, a szervezet részét alkotó és valamilyen biológiai funkció ellátására specializált bioásványok sokszor különleges tulajdonságúak: szűk méret- és alakeloszlás, kémiai tisztaság, olykor szokatlan, nem-egyensúlyi morfológia jellemző rájuk. Megfelelően módosított flagellinekből képzett flagelláris filamentumokat biomineralizációs folyamatokban templátként alkalmazva kívánunk mágneses nanoszálakat előállítani.